Das Gehirn des modernen Menschen besteht zu 0,5%
aus Plastik

Ein Forschungsteam vergleicht die Plastikaufnahme verschiedener Organe und entdeckt: ausgerechnet unsere Gehirne speichern am meisten Plastik. Noch unangenehmer könnte jedoch der Befund sein, dass der Anteil dieser Plastikablagerungen in den letzten Jahren drastisch gestiegen ist. Einen halben Prozent des Gewichts der jüngsten untersuchten Gehirne machten Mikro- und Nanoplastik mittlerweile aus.
Der Mensch ist keine Ausnahme
Erst vor wenigen Jahren wurde die Vermutung laut, dass es auf dem gesamten Globus keinen plastikfreien Ort mehr gebe. Anlass für diese These war damals die Entdeckung von Mikroplastik in der entlegenen Antarktis. Vor wenigen Monaten unternahmen das Alfred-Wegener-Institut und die Universität Basel eine weitere Expedition – mit einer bösen Überraschung.
Die Art der Probennahme der ersten Expedition war ungenau, das genutzte Filtersystem konnte nur Plastikpartikel bis zu einer Größe von 300 Mikrometern erfassen. Kleinere Partikel entgingen also der Messung. Die jüngste Analyse, die bis zu 11 Mikrometer kleine Partikel berücksichtigte, zeigte: über 98% der gesamten antarktischen Plastikmasse war bisher nicht erfasst worden (1). Der gemessene Plastikanteil, mit einem Gewicht über 300 Mikrometer, war also lediglich ein verschwindend geringer Bruchteil des Gesamtaufkommens. Und auch hier gilt, dass Partikel kleiner als 11 Mikrometer in der Analyse untergehen. Damit beschränkte sich die Untersuchung auf Mikroplastik (kleiner als 5mm), denn Nanoplastik ist kleiner als 1 Mikrometer.
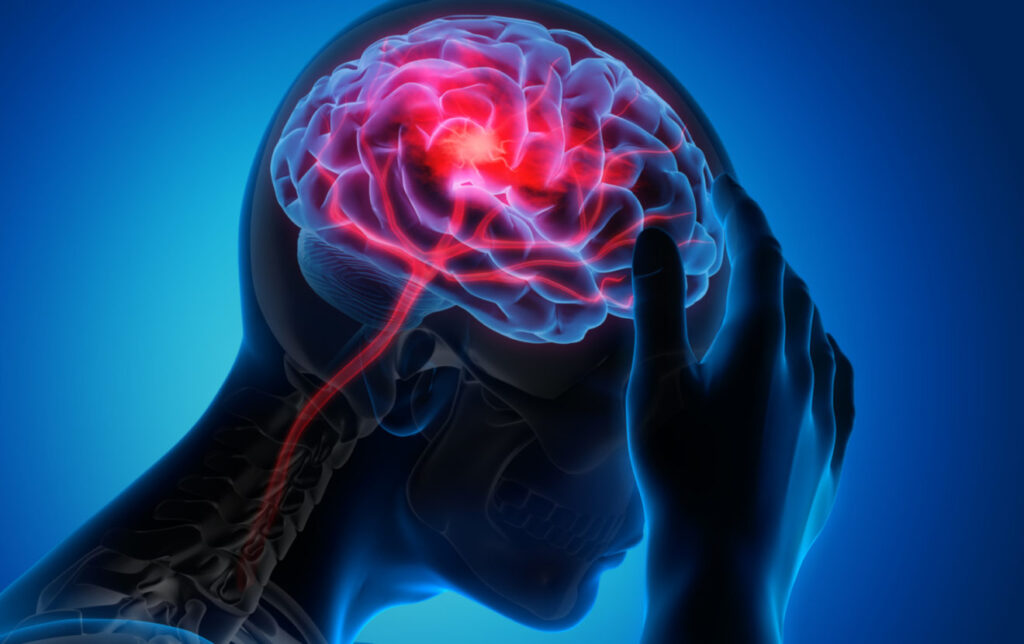

Vor diesem Hintergrund sollte es nicht verwundern, dass auch im Blutkreislauf des Menschen mittlerweile stets eine Dosis Plastik mit fließt. Für die Versorgung des Gehirns zum Beispiel sind die Halsschlagadern zentral. Verklumpen fettige Plaques die Gefäße – meist wegen schlechter Ernährung – oder brechen Teile davon heraus und verstopfen die kleinen Gefäße im Gehirn, so kann es zum Schlaganfall kommen. Eine italienische Forschungsgruppe konnte diesen März im renommierten New England Journal of Medicine zeigen, dass sich den besagten Plaques häufig Mikroplastik beimischt (2). Bei 257 Patientinnen und Patienten wurden die Halsschlagadern geöffnet, Plaques entnommen und auf ihren Plastikgehalt untersucht. Bei mehr als der Hälfte (58%) aller Patientinnen und Patienten war Mikroplastik Bestandteil der ‚Gefäßverkalkungen‘, bei einigen davon auch Nanoplastik. In den drei Jahren nach der Untersuchung zeigte sich sodann, dass die Patientinnen und Patienten mit Plastik-Plaques häufiger an Schlaganfällen und Herzinfarkten litten und insgesamt ein höheres Sterberisiko hatten.

Cholesterinmoleküle im Verdacht
Vor wenigen Tagen erschien schließlich eine US-Studie, welche den Plastikgehalt in verschiedenen Organen untersuchte (3). Die Studie ist noch im Preprint, d.h. sie wurde noch nicht von Kolleginnen und Kollegen begutachtet und in einem Fachjournal veröffentlicht. Das aber dürfte bald folgen, denn die Ergebnisse sind brisant: im Vergleich zu Leber und Niere war im Gehirn ein bis zu 30-fach erhöhter Plastikanteil entdeckt worden. Das Forschungsteam obduzierte dazu 92 Gehirne von Menschen um die 50 Jahre, die zwischen 2016 und 2024 gestorben waren. Besonders beunruhigend: über diesen Zeitraum stieg der Plastikanteil der Gehirne immer weiter an. Menschen, die 2016 gestorben waren, hatten im Schnitt nur halb so viel Plastik im Hirngewebe gespeichert wie Menschen, die dieses Jahr, 2024 verstarben. Für dieses Jahr entsprach der Plastikanteil 4,8mg/g (4800µg/g) oder durchschnittlich 0,5% des gesamten Gehirngewichts. Wenn sich dieser Trend fortsetzt, knackt die Menschheit bald die 1%-Marke. Doch woher kommt dieser Plastikhunger des Gehirns?
Das Gehirn hat Plastikhunger

Wie im Falle der Antarktis ist die Wissenschaft bisher nicht sicher, wie genau das Plastik in unser wichtigstes Organ kommt. Eine mögliche Erklärung stammt aus Mausexperimenten. Bei Mäusen schützte die Blut-Hirn-Schranke, wie auch beim Menschen, die Mäusehirne vor Plastik aus dem Blut. Doch wenn das Plastik über die Nahrung aufgenommen wurde, durchbrach es die Blut-Hirn-Schranke. Die These der Forscherinnen und Forscher ist, dass die Cholesterinmoleküle, welche Fette aus dem Magen-Darm-Trakt in die Organe befördern, das Plastik aufnehmen. Insbesondere Nanoplastik schleusen sie dann, wie ein Trojanisches Pferd, in das Gehirn ein. Dieses besteht zu einem großen Teil aus Fett, da die Axone, die Leitungsbahnen zwischen den Nervenzellen, elektrisch isoliert werden müssen. Eine Aufgabe, welche die Natur mit Myelin, einer Fettschicht, gelöst hat.
Und jetzt?

Üblicherweise enden sowohl wissenschaftliche als auch journalistische Texte zu solchen Themen mit einer Entwarnung. ‘Der Schluss, dass so viel Plastik für unsere grauen Zellen nicht gesund sein kann, ist zu voreilig, denn es gibt ja keine experimentellen Studien, die einen kausalen Mechanismus nachweisen könnten.‘ Theoretisch ist das natürlich richtig – ein kausales Verständnis der Effekte von Plastik auf unsere Gesundheit haben wir bislang nicht. Hierfür fehlen eindeutige Experimente, die ethisch nicht vertretbar wären (man müsste hierfür beispielsweise Menschen in zwei Gruppen einteilen und der einen Gruppe Mikroplastik in die Nahrung beimengen).

Dennoch sind Hinweise wie jene aus der Halsschlagaderstudie bedenklich, und die nackten Zahlen und ihr schneller Zuwachs äußerst erstaunlich. Wenn die intuitiven Bedenken, die wohl die meisten Menschen bei diesen Neuigkeiten haben, sich irgendwann bestätigen sollten, dann nur, weil der Schaden bereits angerichtet und deutlich genug ist, um erkannt zu werden. Ein politisches, notwendigerweise internationales Gegensteuern würde ohnehin Jahrzehnte dauern, sodass Umdenken in der Nutzung von Plastik ein Gebot der Gegenwart sein sollte. Politische Verbote, wie das Plastikstrohhalmverbot der EU, wären die schnellstmöglichen Interventionen. Wenn sich hingegen irgendwann alle gesundheitlichen Bedenken in Luft auflösten, wenn sich beispielsweise zeigte, dass Gehirne auch 5% Plastikanteil tolerieren können – dann hätten wir wenigstens immer noch die Natur vor Müllbergen geschützt.


Energie-Missionen
Systemintegration
Interne elektrochemische Reformierung
Versorgungssicherheit
Amortisation
Weltraumkälte kehrt chemische Regeln um…..

….und bekannte Regeln gelten nicht mehr. Das ist das überraschende Ergebnis einer Arbeitsgruppe
um Frédéric Merkt von eidgenössischen Technischen Hochschule Zürich (ETHZ), die die Reaktion von Wasserstoff mit Amoniak bei extrem niedrigen Temperaturen untersuchte. wirken unter diesen Bedingungen Rotationsenergie und Temperatur genau entgegengesetzt zu ihren Effekten bei hohen Temperaturen.Kohlenstoffringe, Aminosäuren, DNA-Vorläufer: Viele Moleküle, die für den Ursprung des Lebens unerlässlich sind, entstehen schon in den Weiten des Weltalls.
Doch in der eisigen Kälte des interstellaren Raums verlaufen chemische Reaktionen ganz anders als bei uns auf der Erde. Wo Moleküle nur wenig Energie haben, spielen plötzlich subtile Quantenvorgänge eine wichtige Rolle –


Urknallgrafik vor 13.7 Mrd. Jahren
Zwischen den Sternen bilden sich die Bausteine des Lebens nach anderen Prinzipien…
…als auf der Erde. Der Einfluss zweier entscheidender Faktoren wirkt genau umgekehrt.
Kohlenstoffringe, Aminosäuren, DNA-Vorläufer: Viele Moleküle, die für den
Ursprung des Lebens unerlässlich sind, entstehen schon in den Weiten des Weltalls.
Doch in der eisigen Kälte des interstellaren Raums verlaufen chemische Reaktionen
ganz anders als bei uns auf der Erde. Wo Moleküle nur wenig Energie haben, spielen
plötzlich subtile Quantenvorgänge eine wichtige Rolle –

Über Jahrmillionen haben sterbende Sterne das Gas des interstellaren Raums mit
vielerlei Elementen angereichert. Diese Atome verbinden sich in Gas- und Staubwolken
zu einer Vielzahl von Molekülen, die schließlich auch das Leben in Gang brachten.
Doch die Details, wie diese entscheidenden Reaktionen der interstellaren Chemie
ablaufen und mithin, welche Moleküle sich dabei bevorzugt bilden, ist rätselhaft.
Denn die Bedingungen dort sind ganz anders als jene, unter denen man auf der Erde
Chemie betreibt. Das Innere der Gas- und Staubwolken ist eiskalt. Die Molekülbausteine
haben kaum Energie, alles, was passiert, passiert extrem langsam – und normalerweise
irrelevante Quantenunterschiede haben womöglich großen Einfluss.


Die Arbeitsgruppe um Merkt untersuchte deswegen die Reaktion des Wasserstoffions H2+
mit Ammoniak (NH3), zwei in interstellaren Wolken häufig auftretenden Molekülen,
bei Temperaturen, die weniger als 50 Grad über dem absoluten Nullpunkt lagen.
In den Experimenten ersetzten sie Wasserstoff teilweise durch Deuterium, das ein Neutron
mehr hat, um die Reaktionsprodukte voneinander zu unterscheiden. Außerdem verwandelte
sie neutralen molekularen Wasserstoff nicht direkt in das Ion, sondern versetzte eines seiner
Elektronen in einen so genannten Rydberg-Zustand, bei dem dieses extrem weit von den
Atomen weg ist. So reagiert das Molekül bei engen Kontakten wie H2+, ist aber
von Weitem betrachtet neutral, so dass elektrische Felder das Experiment nicht stören.

Zudem kontrollierte das Team, wie schnell das Ammoniakmolekül rotierte: Da eine Seite des Moleküls eine andere Ladung trägt als die andere, »sieht« der Reaktionspartner ein umso neutraleres Molekül, je schneller es rotiert. Da die geladenen Molekülteile für die Reaktion entscheidend sind, verringert der Effekt bei höheren Temperaturen die Wahrscheinlichkeit, dass die beiden Stoffe reagieren. Doch hier erlebte die Arbeitsgruppe eine echte Überraschung: Die schneller rotierenden Moleküle reagierten sogar besser. Ebenfalls anders als bei hohen Temperaturen waren die Stoffe außerdem umso reaktionsfreudiger, je niedriger die Temperatur war. Normalerweise laufen Reaktionen besser ab,
je mehr Energie die Moleküle beim Zusammenstoß haben, also je heißer sie sind.

Die Arbeitsgruppe um Merkt untersuchte deswegen die Reaktion des Wasserstoffions H2+ mit Ammoniak (NH3), zwei in interstellaren Wolken häufig auftretenden Molekülen, bei Temperaturen, die weniger als 50 Grad über dem absoluten Nullpunkt lagen. In den Experimenten ersetzte sie Wasserstoff teilweise durch Deuterium, das ein Neutron mehr hat, um die Reaktionsprodukte voneinander zu unterscheiden. Außerdem verwandelte sie neutralen molekularen Wasserstoff nicht direkt in das Ion, sondern versetzte eines seiner Elektronen in einen so genannten Rydberg-Zustand, bei dem dieses extrem weit von den Atomen weg ist. So reagiert das Molekül bei engen Kontakten wie H2+, ist aber von Weitem betrachtet neutral, so dass elektrische Felder das Experiment nicht stören.

Zudem kontrollierte das Team, wie schnell das Ammoniakmolekül rotierte: Da eine Seite des Moleküls eine andere Ladung trägt als die andere, »sieht« der Reaktionspartner ein umso neutraleres Molekül, je schneller es rotiert. Da die geladenen Molekülteile für die Reaktion sind, verringert der Effekt bei höheren Temperaturen die Wahrscheinlichkeit, dass die beiden Stoffe reagieren. Doch hier erlebte die Arbeitsgruppe eine echte Überraschung: Die schneller rotierenden Moleküle reagierten sogar besser. Ebenfalls anders als bei hohen Temperaturen waren die Stoffe außerdem umso reaktionsfreudiger, je niedriger die Temperatur war. Normalerweise laufen Reaktionen besser ab, je mehr Energie die Moleküle beim Zusammenstoß haben, also je heißer sie sind.

Letzterer Befund leuchtet ein. Bei so niedrigen Temperaturen ist entscheidender, wie viel Zeit die Stoffe in unmittelbarer Nähe zueinander verbringen. Dass allerdings eine schnellere Rotation die Reaktion sogar erleichtert, war nicht absehbar. Hinter dem Effekt stecken subtile Quanteneffekte, durch die der erste Schritt der Reaktion, die elektrostatische Wechselwirkung zwischen den Molekülen, erleichtert wird. Dieser Befund sei vermutlich wichtig für viele vergleichbare Reaktionen der interstellaren Chemie, schreiben die Fachleute. Denn ein geladenes Molekül zeigt unabhängig von seiner Rotation immer seine Ladung nach außen. Bei einem neutralen Molekül dagegen spielt die genaue Ladungsverteilung und deren Ausrichtung bei einem Kontakt mit einem anderen Stoff eine viel größere Rolle.


Die Arbeitsgruppe um Merkt untersuchte deswegen die Reaktion des Wasserstoffions H2+ mit Ammoniak (NH3), zwei in interstellaren Wolken häufig auftretenden Molekülen, bei Temperaturen, die weniger als 50 Grad über dem absoluten Nullpunkt lagen. In den Experimenten ersetzte sie Wasserstoff teilweise durch Deuterium, das ein Neutron mehr hat, um die Reaktionsprodukte voneinander zu unterscheiden. Außerdem verwandelte sie neutralen molekularen Wasserstoff nicht direkt in das Ion, sondern versetzte eines seiner Elektronen in einen so genannten Rydberg-Zustand, bei dem dieses extrem weit von den Atomen weg ist. So reagiert das Molekül bei engen Kontakten wie H2+, ist aber von Weitem betrachtet neutral, so dass elektrische Felder das Experiment nicht stören.



